Les femmes qui n’ont pas la mutation génétique connue et identifiée dans leur famille, on un risque identique à la population générale d’avoir un cancer du sein ou de l’ovaire, soit +/- 12% pour le cancer du sein (1 femme sur 8) et +/- 1% pour le cancer de l’ovaire (1 femme sur 100).
L’âge du cancer du sein est plus précoce lorsque l’on a une mutation BRCA. En moyenne 40 ans pour BRCA1 et 43 ans pour BRCA2.
D’après les résultats d’études actuels, une femme a un risque au cours de sa vie de développer un cancer du sein de 51 à 75 % si elle est porteuse d’une mutation BRCA1 et de 33 à 55 % si elle est porteuse d’une mutation BRCA2 . Le risque augmente à partir de 30 ans. Ces résultats sont cependant variables d’une famille à l’autre.
 Lorsqu’une femme porteuse d’un gène muté (BRCA 1 ou BRCA 2) a déjà eu un cancer du sein, le risque se porte essentiellement sur l’autre sein. Il est 4 fois plus important qu’une femme sans mutation et de l’ordre de 20 à 40 %. Ce risque est augmenté dans les situations suivantes : si l’on est porteuse d’une mutation BRCA1, si le 1er cancer a eu lieu avant 40 ans, si le 1er cancer a eu lieu avant 50 ans avec 2 apparentés du premier degré (parents, frères et soeurs, enfants) ayant également déclarée un cancer du sein.
Lorsqu’une femme porteuse d’un gène muté (BRCA 1 ou BRCA 2) a déjà eu un cancer du sein, le risque se porte essentiellement sur l’autre sein. Il est 4 fois plus important qu’une femme sans mutation et de l’ordre de 20 à 40 %. Ce risque est augmenté dans les situations suivantes : si l’on est porteuse d’une mutation BRCA1, si le 1er cancer a eu lieu avant 40 ans, si le 1er cancer a eu lieu avant 50 ans avec 2 apparentés du premier degré (parents, frères et soeurs, enfants) ayant également déclarée un cancer du sein.
Le risque de récidive de cancer du sein est identique que l’on soit porteuse ou non d’une mutation BRCA durant les 5 premières années mais il est plus élevé après 5 ans. La mastectomie entraîne une réduction plus importante à 15 ans du risque d’un 2ème cancer dans le même sein que le traitement conservateur (tumorectomie), mais sans impact démontré sur la survie.
Le risque d’avoir un cancer du sein peut être pratiquement diminué de moitié si les ovaires ont été enlevés à 40 ans lorsque la patiente n’est pas ménopausée et n’a développé aucune tumeur.
Un homme porteur du gène muté BRCA 2 présente un risque d’environ 6% de faire dans sa vie un cancer du sein.
Pour le cancer de l’ovaire (on parle de plus en plus de cancers pelvien ou tubo-ovarien) le risque est de 22-59% pour le BRCA 1 et augmente à partir de 40 ans, et de 4-18% pour le BRCA 2 et augmente à partir de 50 ans. Il est aussi plus précoce que les cancer de l’ovaire non liés à BRCA.
L’âge moyen de la survenue d’un cancer de l’ovaire est 52 ans (+/- 10 ans) pour BRCA1 et 60 ans (+/- 11 ans) pour BRCA2.
Certaines mutations (plutôt sur BRCA 2) semblent associées à un faible risque de cancers du pancréas, de mélanome, et pour l’homme de cancer de la prostate.
La transmission de génération en génération de la mutation génétique n’est pas obligatoire. Nous possédons chacun la moitié des gènes de notre père et la moitié des gènes de notre mère. Le risque de transmettre le gène muté que l’on a nous même hérité est donc de 50%. Nous ne pouvons transmettre une mutation que l’on a pas reçue.
En France, il n’y a pour le moment pas de traitement préventif visant à réduire le risque du cancer du sein d’origine héréditaire. Seuls une intervention chirurgicale peut le diminuer.
La mastectomie bilatérale prophylactique (MBP) est la mesure la plus efficace pour gommer le risque de cancer du sein. Elle permet une réduction importante du risque de 95%. Le risque annuel est réduit à moins de 1%.
Elle est envisagée principalement avec une reconstruction immédiate ou différée, et la PAM (Plaque Aréolo-Mamelonnaire) peut être conservée. Les deux principales techniques utilisées en reconstruction bilatérale sont les implants et les lambeaux libres avec épargne musculaire. La MBP sans reconstruction peut également être demandée.
Cette chirurgie préventive concerne les femmes qui n’ont pas encore eu de cancer du sein.
La décision d’un tel choix est propre à chacune et doit être mûrie longuement. La technique de reconstruction, le contexte familial, le nombre de personnes touchées dans la famille, le décès d’un proche, un antécédent de cancer, et l’âge, pourront influer sur ce choix.
Elle n’est pas recommandée avant l’âge de 30 ans et se discute après 65 ans.
Eventuellement, dans le cas où il existe un antécédent de cancer du sein, la chirurgie reste préventive pour l’autre sein mais ne supprime pas le risque de rechute du premier cancer. Suivant les caractéristiques du cancer du sein et sa probabilité d’évolution entre 3 et 5 ans, il est prudent de laisser passer un délai avant d’entreprendre une ablation/reconstruction afin de s’assurer de l’absence d’évolution rapide.
En cas d’antécédent personnel de cancer des annexes (ovaire, trompe ou péritoine), un délai de 5 ans sera observé avant d’envisager l’ablation/reconstruction des seins.
Quelque soit la situation, avec ou sans cancer du sein, il n’y a jamais de caractère d’urgence à effectuer cette chirugie préventive des seins.

Pour le cancer de l’ovaire, la seule façon d’éviter ce risque est d’enlever chirurgicalement les ovaires et surtout les trompes. Cette intervention, appelée annexectomie, est recommandée à 40 ans pour celles qui ont une mutation BRCA 1 et 45 ans pour BRCA 2. Cette intervention se fait par coelioscopie, ou laparoscopie, ce qui permet une hospitalisation et une convalescence brèves. Cette intervention n’annule cependant pas complètement le risque.
Avant l’âge de 40 ans, l’annexectomie n’est pas recommandée sauf en cas de cancer de l’ovaire, ou trompe ou péritoine, plus précoce dans la famille.
L’annexectomie chez les femmes porteuses de mutation BRCA1/2 avec un cancer du sein (et quels que soient les gestes chirurgicaux mammaires effectués), entraine une réduction de risque du cancer des annexes, du cancer du sein, et un bénéfice sur la survie quelque soit l’était des récepteurs hormonaux du cancer du sein (hormono-dépendant ou triple négatif).
Pour toutes les femmes, l’annexectomie est une stratégie de réduction de risque à recommander.
Les risques de complications et les conséquences de ces chirurgies (insensibilité, impact sur la sexualité, effet de la ménopause…) sont abordés lors de la consultation indiquant le résultat de la recherche génétique.
Un accompagnement psychologique dans le cadre de ces chirurgies préventives peut se révéler fort utile.
Lorsque votre arbre généalogique laisse apparaître un risque héréditaire de cancer du sein, un dépistage vous sera proposé généralement à partir de 30 ans ou plus tôt si les cancers apparus dans la famille sont plus précoces.
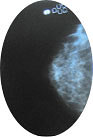 • Pour les seins :
• Pour les seins :
Un examen clinique 2 fois par an chez votre gynécologue, une mammographie annuelle (souvent associée à une échographie) concomitante avec une IRM jusqu’à 65 ans. La mammographie annuelle peut se poursuivre sans limite d’âge. Il est important de réaliser les examens radiologiques annuels au même endroit, dans le même centre par la même équipe.
• Pour les ovaires :
Un examen clinique annuel.
 Il n’est pas nécessaire de mesurer le marqueur CA125 (antigène produit lors d’un cancer de l’ovaire dans le sang) car le résultat est aléatoire et difficilement interprétable.
Il n’est pas nécessaire de mesurer le marqueur CA125 (antigène produit lors d’un cancer de l’ovaire dans le sang) car le résultat est aléatoire et difficilement interprétable.
Le dépistage du cancer du sein est plus facile que celui du cancer de l’ovaire. Beaucoup de femmes découvrent elles-même une « boule » dans leur sein alors que le dépistage du cancer de l’ovaire est rendu difficile par la localisation des ovaires, par l’extension fréquente de la tumeur directement dans le péritoine et aussi parce que l’échographie pelvienne n’est pas un examen très performant pour la détection des cancers des ovaires.
Si vous avez été touchée par un cancer du sein, la surveillance est identique avec toutefois une nuance pour la mammographie qui demande alors 2 incidences.
Lorsqu’une chirurgie préventive ou prophylactique a été effectuée pour les seins (MBP) ou les ovaires annexectomie), un examen clinique annuel est recommandé pour les seins et un examen gynécologique habituel si l’utérus a été conservé. Il n’y a plus de surveillance radiologique sauf devant des signes cliniques ou fonctionnels.
La prise en charge des cancers héréditaires du sein n’est pas différente des autres cancers du sein.
Il y a juste une différence pour le risque de cancer du sein contro-latéral (dans l’autre sein) qui est plus important pour les femmes qui ont une mutation génétique. Dans ce cas, un geste chirurgical plus large peut être envisagé, voire l’ablation bilatérale.
Mais des études prometteuses sont actuellement en cours en France pour l’utilisation d’un nouveau type de médicaments : les inhibiteurs de PARP. Ceux-ci vont probablement prendre une importance considérable dans le traitement des cancers liés aux mutations BRCA.
En décembre 2014, un médicament de ce type, le Lynparza (Olaparib), a déjà obtenu l’autorisation européenne de mise sur le marché pour traiter les cancers de l’ovaire liés à une mutation BRCA.
C’est la 1ère thérapie ciblée destinée aux femmes porteuses d’une mutation BRCA.
La contraception hormonale pour les femmes porteuses BRCA indemnes de cancer ne présente aucune contre-indication. Les règles de prescription sont les mêmes que pour les femmes de la population générale. L’utilisation des contraceptifs oraux diminue le risque de cancer des annexes, y compris chez les femmes porteuses d’une mutation de BRCA1/2.
Elle est cependant contre-indiquée pour les femmes ayant un antécédent personnel de cancer du sein.
Après l’annexectomie, un traitement hormonal de la ménopause peut être precrit également aux femmes indemnes de cancer du sein. La durée de prescription est la même que pour les femmes de la population générale. Il reste contre-indiqué en cas d’antécédent de cancer du sein.
Il n’y a pas lieu non plus de différencier la population des femmes porteuses d’une mutation de BRCA1/2 de la population générale dans les règles de traitement de l’infertilité. Peu de données sont disponibles pour les femmes BRCA concernant une augmentation du risque de cancers du sein et de l’ovaire associé à ces traitements.
Le traitement par analogues de la GnRH ou la congélation d’ovocytes matures (obtenus avec ou sans stimulation ovarienne) peuvent être proposés pour préserver la fertilité avant chimiothérapie aux femmes touchées par un cancer du sein, porteuses d’une mutation de BRCA et dûment informées des limites des connaissances scientifiques.
La greffe du cortex ovarien, après cryoconservation, n’est pas indiquée en raison du principe de précaution.
Les informations que vous détenez, relatives à votre mutation génétique, peuvent servir à d’autres personnes de votre famille. Depuis le décret du 20 juin 2013, vous avez le devoir d’avertir les membres de votre famille susceptibles d’être concernés. Soit vous vous engagé à les prévenir par vous-même si vous vous en sentez capable, soit par l’intermédiaire de l’oncogénéticien. Il faudra alors lui donner les coordonnées des différents membres de votre famille. Un courrier leur sera envoyé, indiquant qu’une anomalie génétique d’origine familiale a été mise en évidence chez une personne de leur famille, et les invitant à consulter un service oncogénétique pour avoir plus de précisions. Aucune indication sur votre identité ne pourra être divulguée.
 Vouloir les prévenir soi-même n’est pas une démarche facile à faire et réserve parfois des surprises…
Vouloir les prévenir soi-même n’est pas une démarche facile à faire et réserve parfois des surprises…
Il est fort probable que les autres membres de votre famille se doutent du caractère familial des cancers du sein et/ou de l’ovaire déjà existants. Ils pourront être intéressés par vos informations et même vous remercier de les avoir prévenus. Des liens peuvent aussi se resserrer. En revanche, certaines personnes ne sont pas prêtes à recevoir une telle information. Elle les inquiétera, les perturbera. Vous ne pouvez pas y faire grand chose.
Pour les aider, vous pouvez expliquer succinctement le déroulement d’une consultation oncogénétique, leur faire parvenir les résultats de l’analyse génétique, leur donner les coordonnées du service oncogénétique le plus proche de chez eux, leur proposer d’en parler avec leur médecin généraliste.
 Certains préféreront une communication directe de vive voix ou par téléphone, d’autres par courrier.
Certains préféreront une communication directe de vive voix ou par téléphone, d’autres par courrier.
S’il s’agit de l’annoncer à ses enfants, s’ils sont jeunes, vous aurez peut-être un peu de temps avant de leur dire. La surveillance est à faire au plus tôt à partir de 20 ans dans certaines familles (avec des cas jeunes de cancers du sein ou de l’ovaire), et une tumeur ne se développera qu’à l’âge adulte. Il faut aussi qu’ils soient majeurs et prennent la décision eux-mêmes de faire le test génétique.
S’ils sont adolescents, regardez leur programme d’SVT, la génétique y est abordée au collège, et l’exemple des cancers d’origine héréditaire est souvent donné en cours au lycée. Ils y auront déjà peut-être pensé eux-mêmes.
